La neuromodulazione sacrale nel trattamento della cistite intestiziale
L'eziologia della CI é a tutt'oggi sconosciuta tuttavia numerose sono state le teorie postulate per spiegarne il meccanismo fisiopatologico. Le condizioni iniziali in grado scatenare la CI comprenderebbero: disturbi di svuotamento vescicale, alterazioni del pavimento pelvico, infezioni delle vie urinarie, condizioni di spasticità uretrale, Tutte queste condizioni innescherebbero un complesso processo infiammatorio, responsabile della sindrome.
Circa il 10% dei pazienti affetti da CI non mostrano un sostanziale miglioramento clinico in seguito alle terapie convenzionali. Esperienze cliniche suggeriscono che la Neuro Modulazione Sacrale (NMS) può normalizzare la funzione motoria della vescica e dei muscoli del pavimento pelvico, nonché di quella sensitiva. Sulla base di dati desunti da una review della Letteratura, la NMS si configura come una valida alternativa terapeutica in casi di CI refrattaria alle tradizionali terapie, e prima di prendere in considerazione la chirurgia maggiore.
La possibilità di effettuare l'impianto definitivo in due tappe con tecnica percutanea, che é procedura minimamente invasiva, consente una valutazione della risposta alla terapia migliore di quanto non consenta il PNE test, in quanto prevede l'utilizzo di un elettro quadripolare, in luogo del monopolare, una minore tendenza allo sposizionamento dell'elettrodo ed un più lungo periodo di valutazione.
Parole chiave: Cistite interstiziale, Sindrome della vescica dolorosa, Dolore Pelvico Cronico, Neuro Modulazione Sacrale.
ABSTRACT
Interstitial Cystitis (IC) is a chronic and often debilitating disease, characterized by pelvic and perineal pain, urgency and increased urinary frequency. Pain is the principal and almost defining symptom of IC.
The etiology of IC still remains unknown and many theories have been proposed in an attempt to explain the pathophysiologic mechanisms. The initial conditions which lead to IC could include: bladder voiding disorders, pelvic floor pathology, urinary tract infections, urethral spasticity, changes in the bladder wall increasing its permeabilty to solutes. All these conditions would cause a complex inflammatory process, responsible for the sindrome.
Approximately 10% of the patients with IC do not show significant improvement after conventional therapy.
Clinical experience suggests that Sacral Nerve Stimulation can normalize motor function of the bladder and pelvic floor muscles, as well as sensory function. On the basis of data taken from a review of the Literature, SMS appears as a valid therapeutic option in the case of IC which is refractory to traditional treatment, before considering major surgery.
The possibility to carry out the definitive implant in two steps with the percutaneous technique, which is a mini-invasive procedure, allows a better evaluation of the response to the therapy compared to the PNE test, as it uses a quadripolar electrode in place of a monopolar one, there is less tendency to displacement of the electrode and the period of evaluation is longer.
Key words: Interstitial cystitis, Painful bladder syndrome, Chronic Pelvic Pain, Sacral Nerve Simulation
Introduzione
La Cistite Interstiziale (CI) é una patologia cronica e spesso debilitante, caratterizzata da dolore pelvico e perineale, al quale si associa urgenza ed aumento della frequenza minzionale. Il dolore é il sintomo principale e peculiare della CI.
Dati desunti dall' Interstitial Cystitis Database mostrano che il 93,6% dei pazienti affetti da CI dichiara di essere affetto da una sintomatologia algica 1. Il dolore é localizzato nell'80,4% a livello del basso ventre, nel 73,8% all'uretra, nel 65,7% in regione lombare e glutea e nel 51,5% dei casi in area vaginale. Molti pazienti infine hanno difficoltà a definire una posizione esatta del dolore. Spesso l'entità del dolore é talmente elevata da impedire le comuni attività della vita quotidiana con un notevole impatto negativo sulla qualità della vita.
Baskin e Tanagho hanno riportato diversi casi in cui la rimozione della vescica in caso di CI "end stage", non portava alla risoluzione della sintomatologia, sottolineando come tale patologia deve considerarsi come una sindrome diffusa a tutta la pelvi e non ad esclusiva localizzazione vescicale 2.
Il primo a parlare di tale condizione fu Hunner nel 1914 e successivamente Bourque nel 1951 3. Recentemente tale patologia é stata meglio definita come "Chronic Pelvic pain" o " Painful Bladder Syndrome" mettendo in risalto la natura dolorosa della patologia in associazione a sintomi urinari di tipo irritativo 4. Sia l'etiologia che la fisiopatologia della CI sono ad oggi molto poco conosciute così come la terapia che non é attualmente universalmente accettata. Per ora quindi una diagnosi di CI viene effettuata solo per esclusione, attraverso una serie di importanti valutazioni cliniche associate ad esami laboratoristico-strumentali.
Oravisto nel 1975 é stato uno dei primi studiosi ad effettuare uno studio epidemiologico sulla cistite interstiziale. In Finlandia studiò una popolazione di un milione di individui e trovò un'incidenza del 18.1 su 100.000 donne 5.
Held et al. hanno invece trovato che l'incidenza di tale patologia era il doppio di quella mostrata dallo studio di Oravisto. Gli Autori hanno inoltre evidenziato che la durata dei sintomi prima della diagnosi variava dai due ai quattro anni. L'età media della popolazione indagata era di 40 anni, il 15% dei soggetti affette era di origine ebraica, paragonata al 3% della popolazione generale. Questo studio dimostrò inoltre, che attorno a tale patologia gravano degli enormi costi sia per quello che riguarda i giorni di assenza dal lavoro che medici 6.
Studi più recenti effettuati da Curhan hanno dimostrato che l'incidenza della CI é di gran lunga più elevata rispetto a quanto si credeva: nuove proiezioni indicano una prevalenza di 700.000 persone negli Stati Uniti, ed un'incidenza del 50% più alta di quanto valutato in precedenza 7, 8
Un così forte aumento dell'incidenza della malattia é associato ai più fini criteri diagnostici e clinici sviluppati negli anni per il riconoscimento della malattia.
L'eziologia della CI é a tutt'oggi sconosciuta, ed é probabile che una varietà di fattori ne possa essere responsabile.
Numerose sono le teorie postulate per spiegare il meccanismo fisiopatologico che sottende la cistite interstiziale, anche se nessuna attualmente é in grado da sola di spiegare completamente la malattia. Le condizioni iniziali in grado scatenare la CI comprenderebbero: disturbi di svuotamento vescicale, alterazioni del pavimento pelvico, infezioni delle vie urinarie, condizioni di spasticità uretrale, alterazioni della parete vescicale che sarebbe maggiormente permeabile ai soluti urinari. Tutte queste condizioni innescherebbero un complesso processo infiammatorio, responsabile della sindrome.
Teoria della ridotta permeabilità vascolare
I GlicosAminoGlicani (GAG) sono copolimeri lineari formati dall'alternanza di radicali esosaminili e uronili, mentre i cheratansolfati da esosaminili e galattosili.
Vengono arbitrariamente suddivisi in 4 famiglie:
- Eparine ed eparansolfati
- Condroitine e dermatansolfati
- Ialuronati
- Cheratansolfati
Numerosi studi hanno chiarito che i GAG localizzati a livello dell'urotelio costituiscano il principale meccanismo di barriera tra la parete cellulare e i soluti contenuti nelle urine 9.
Alcuni Autori hanno pertanto supposto che nei pazienti con CI questa superficie di GAG sia difettosa. Le cause sono molteplici, includendo una ridotta solforilazione dei proteoglicani, una diminuita densita dei GAG o la presenza di composti come la protamina che inattivano i GAG. La superficie vescicale di individui normali trattata con protamina perde la sua permeabilità ; cio é alla base di quei meccanismi che inducono frequenza e urgenza minzionale e dolore vescicale, sintomi costantemente presenti nei pazienti affetti da CI. I GAG intensificano inoltre l'attività delle pompe ioniche invertendo il gradiente di concentrazione dei soluti nelle membrane 10. In caso di CI, in conseguenza della accresciuta permeabilità di membrana, la concentrazione perivascolare di K+ aumenta rispetto alla norma , con conseguente vasocostrizione, che a sua volta rende impossibile il riassorbimento degli ioni K+. Tutto ciò crea una ischemia parietale della vescica che poi porta ad un ingresso diretto delle urine nell'interstizio delle fibre del detrusore e nei suoi propriocettori con eccitazione di entrambi e conseguente urgenza minzionale.
Niku et al. hanno dimostrato ridotti livelli di escrezione di glicosaminoglicani (GAG) nei pazienti affette da CI rispetto ai controlli: la riduzione dei GAG aumenterebbe la permeabilità della mucosa vescicale con conseguente infiammazione della sottomucosa. Tali modificazioni infiammatorie stimolerebbero le fibre afferenti del dolore, con conseguente comparsa di dolore viscerale 11.
Teoria autoimmune
Molti ricercatori hanno postulato una patogenesi autoimmune per la CI, avendo riscontrato, in questa patologia, un incremento di cellule immunitarie e di anticorpi antinucleari rispetto ai controlli 12. Questa ipotesi sarebbe supportata dall'osservazione di una buona risposta alla terapia steroidea 13
Alterazioni del pavimento pelvico
Tutti gli organi contenuti nella pelvi, così come la muscolatura del pavimento pelvico, hanno la stessa innervazione S 2 -S 4 , e sono coinvolti negli stessi meccanismi riflessi. Pertanto l'alterazione anche solo di un organo può avere effetto, con meccanismo riflesso, anche sugli altri organi. Questo potrebbe almeno in parte spiegare perché molte pazienti affette da CI hanno anche problemi ginecologici (Endometriosi) e/o gastrointestinali (intestino irritabile). Il controllo degli sfinteri e, in generale, dei muscoli del pavimento pelvico, é un meccanismo acquisito dopo la nascita: se esso é appreso in modo sbagliato ciò può indurre disturbi minzionali con ipersensitività e spasticità del meccanismo sfinterico uretrale e della vescica. Ciò sarebbe in grado di spiegare il dolore pelvico cronico caratteristico di questa affezione 14
Mastocitosi
Studi morfologici hanno dimostrato un aumento del numero e dell'attivazione delle mastcellule nella CI 15. Queste cellule sarebbero localizzate sia nella sottomucosa sia a livello detrusoriale, a differenza di quanto accade nelle cistiti batteriche in cui tali cellule sono individuate solo a livello della sottomucosa. Sono inoltre state dimostrate sottopopolazioni di mastcellule con un aumentata degranulazione: quest'ultima comporta il rilascio di istamina con secondaria iperemia, vasodilatazione, aumento delle cellule infiammatorie, e stimolazione delle fibre C che rilasciano neuropeptidi, con secondario danno della mucosa, e fibrosi della sottomucosa 16. L'attivazione delle mastcellule sarebbe il risultato del rilascio di neurotrasmettitori (VIP, sostanza P, acetilcolina, NYP), indotto da un riflesso assonale.
Fattori neurotropici
Altre sostenze neurotrope coinvolte nella patogenesi della CI sono:
- La sostanza P, sintetizzata dalla fibre C, ed implicata in numerose reazioni infiammatorie 17.
- La bradichinina, che risulta aumentata nella parete vescicale delle persone affette da CI, con secondaria attivazione del sistema callicreina-chinina 18.
- Il Nerve Growth Factor (NGF) che induce rapida sensibilizzaione delle fibre afferenti nocicettive 19.
Teoria infettiva
Le infezioni urinarie sono state considerate possibile causa di CI a causa della similitudine nell'epidemiologia (in più del 90% dei casi sono colpite donne); nella sintomatologia (urgenza, frequenza, dolore); nel quadro istologico (ulcerazioni epiteliali, infiammazione della sottomucosa, presenza di mastcellule, aumento della permeabilità di parete, riduzione dello strato dei GAG di parete) 20. In realtà non é stato mai possibile isolare dalle biopsie vescicali di pazienti affette da CI, con urinocolture positive, batteri o virus responsabili dell'infezione 21.
Cistite Interstiziale e Dolore
La CI può essere considerata, in alcune pazienti, una malattia primaria della vescica mentre, in altre, una sindrome pelvica diffusa, che non risponde alle terapie sulla vescica o altri organi. Questo può dipendere dalla componente neurogenica della CI; difatti, complessi meccanismi riflessi sacrali mediano le funzioni del basso tratto urinario regolati a loro volta da un controllo, inibitorio o eccitatorio, proveniente dai centri nervosi più alti (per es. il centro pontino della minzione).
"Disbehaviours", chirurgia, infezioni e condizioni neuropatiche possono mettere in moto una cascata di eventi con input afferente nocicettivo.
Il sistema nervoso centrale, quindi, risponde ad un stimolo normale con un rilascio eccessivo di neuromediatori, con secondario squilibrio nei riflessi sacrali, che causa una eccessiva eccitazione o inibizione dell'attività di svuotamento vescicale.
Le fibre C, esposte a stimoli nocicettivi ripetuti, rimangono parzialmente depolarizzate. Il risultato clinico di questa condizione é appunto il dolore.
Tradizionalmente vengono impiegati 4 gruppi di criteri diagnostici:
- Complesso dei sintomi desunti dal diario minzionale
- Test di laboratorio e test al potassio
- Urodinamica
- Cistoscopia in narcosi ed istologia.
Diario minzionale
La compilazione del diario minzionale é assolutamente necessaria per la quantificazione dei sintomi urinari: frequenza urinaria diurna, nicturia, urgenza, e per la valutazione della risposta alla terapia. Due questionari validati (Interstitial Cystitis Problem Index - ICPI, e Interstitial Cystitis Symptoms Index - ICSI) sono di grande aiuto per la valutazione ed il trattamento dei pazienti 22
Test al potassio
Il test al potassio é utilizzato come "marker clinico" della CI 23. Esso valuta la comparsa di un " discomfort" vescicale mediante Analogo Visivo dopo l'instillazione di 0,4 M di KCL 24. Il razionale dell'uso di questo test nella diagnosi della CI sta nel fatto che la parete vescicale é abnormemente permeabile ai soluti 25. La positività del test al potassio é spesso correlato con le variazioni sintomatologiche legate alla dieta (alcol, succo di arancia) 26
Urodinamica
L'urodinamica fornisce una misurazione oggettiva della funzionalità del tratto urinario basso. Questo esame non é universalmente accettato da Urologi e Ginecologi che raramente usano l'Urodinamica nella valutazione del dolore pelvico cronico 27. E' stata comunque dimostrata una forte correlazione tra frequenza diurna, notturna e delle 24 ore e i dati urodinamici di Volume Vescicale al primo stimolo e Massima Capacità Cistometrica. Il sintomo urgenza é invece ben correlato con la comparsa di iperattività detrusoriale. L'urodinamica può inoltre valutare la risposta al trattamento con NMS e guidarne la programmazione. Infatti, sulla guida dell'urodinamica la NMS può incrementare la massima capacità vescicale, il volume vescicale al primo stimolo, e ridurre la frequenza minzionale diurna e notturna 28.
Cistoscopia in Narcosi ed Esame Istologico
La valutazione cistoscopica della vescica, in anestesia generale, é un'essenziale manovra diagnostica e terapeutica. Basandosi sul reperto cistoscopico, la CI é stata tradizionalmente classificata in forma ulcerativa (caratterizzata dall'osservazione cistoscopica delle "Ulcere di Hunner") e non ulcerativa 29. Non ancora chiarito é se questa classificazione rappresenti differenti stadi della stessa patologia o differenti processi patologici 30. Nonostante molti studiosi continuino a considerare le ulcere di Hunner una "conditio sine qua non" per la CI, si valuta che la loro incidenza vari dal 5 al 20% dei casi di CI. Un altro reperto cistoscopico spesso rilevato nei soggetti affetti da CI sono caratteristiche emorragie a forma di fragola definite "glomerulation, oltre ad un profuso sanguinamento. In genere esse non sono visualizzabili in corso di un primo riempimento vescicale, ma in corso di un secondo riempimento, effettuato con un riempimento che avviene mediante una sacca posta ad 1 metro di altezza dalla vescica del paziente (pressione di 80 cm H 2 O). Probabilmente neanche questo reperto é specifico di CI, avendo un recente studio dimostrato la presenza di glomerulation anche in donne non affette da CI 31. E' stato inoltre dimostrato che la presenza o assenza di ulcerazioni o glomerulation non si correla con la sintomatologia 30 .
Il quadro istologico consiste in una pancistite transmurale cronica, contraddistinta da un coinvolgimento degli strati più profondi della parete vescicale, con infiammazione e fibrosi, così come la presenza di numerosi mastociti. Ciò potrebbe essere di importante rilevanza eziologia poiché queste cellule sotto adeguata stimolazione immunologica chimica o meccanica rilasciano granuli contenenti istamina ed altre sostanze che inducono contrazioni della muscolatura liscia, vasodilatazione e contrazione neurale 32.
Numerosi sono i trattamenti utilizzati nei pazienti affetti da CI.
Terapie orali tradizionali:
- pentosanpolisolfato
- cimetidina
- anticolinergici
Nuovi farmaci orali:
- gabapentina (elettivo nel trattamento del dolore)
- suplatast tosilato
- bioflavonoidi
- NGF
- Antagonista del leukotriene-1
Farmaci intravescicali:
- Eparina
- BCG
- DMSO
- Acido ialuronico
- Botox
- Vanilloidi
Terapie mininvasive:
- Idrodistensione
- Neuromodulazione sacrale
- Stimolazione retrograda delle radici sacrali
- Blocco lombare epidurale
- Stimolazione del nervo tibiale posteriore
Terapie maggiori:
- Enterocistoplastica
- Cistectomia con condotto ileale
- Neovescica ileale ortotopica
- Cistectomia con conservazione del trigono
Circa il 10% dei pazienti affetti da CI non mostrano un sostanziale miglioramento clinico in seguito alle terapie standard orali o intravescicali 33. Il trattamento chirurgico della CI, che comprende la cistectomia sopratrigonale o la cistectomia totale con neovescica é riservata solo ai casi di CI "end stage". Tale chirurgia maggiore non é scevra da rischi e complicanze post-operatorie, come ritenzione urinaria, ostruzione intestinale, malassorbimento e compromissione della funzionalità renale; inoltre più del 25% delle pazienti lamentano persistenza della sintomatologia dolorifica; tali osservazioni hanno notevolmente ridotto l'utilizzo di tali procedure 34 .
Il fallimento delle terapia tradizionali per la CI può essere attribuito ad una comprensione incompleta della fisiopatologia di questa affezione. Infatti mentre la CI può essere considerata in alcune pazienti come una affezione primaria della vescica, in altre si configura come una sindrome diffusa a tutta la pelvi, che non risponde pertanto a terapia dirette unicamente alla vescica 35. Ciò può essere spiegato sulla base della componente neurogenica della CI, in cui stimoli cronici determinano una "upregulation" dei nervi pelvici con una secondaria disfunzione dei muscoli del pavimento pelvico. Sulla base di tali presupposti si può spiegare il ricorso alle tecniche di stimolazione elettrica per il trattamento della CI. Numerosi studi sono stati pubblicati per valutare vari tipi di stimolazione, compresa l'agopuntura 36, la TENS, la stimolazione intravaginale o intrarettale o la stimolazione del tibiale 37 38 39. Ed alcuni di questi studi hanno dimostrato una buona risposta, in particolare della stimolazione elettrica trans-cutanea, sui sintomi della CI e nello specifico sul dolore, anche se i risultati a lungo termine di tali terapie sono poco soddisfacenti 40.
Questi presupposti scientifici sono stati alla base dell'utilizzo della neuromodulazione sacrale nella CI. E' ben noto infatti che numerosi meccanismi riflessi sacrali sono in grado di mediare la funzione del basso tratto urinario. Alterazioni funzionali, trattamenti chirurgici, infezioni, condizioni neuropatiche innescherebbero una cascata di eventi che esita nell'attivazione di un input afferente nocicettivo. Il sistema nervoso centrale risponderebbe a questi stimoli con un incremento dell'attività efferente, con conseguente squilibrio tra afferenze ed efferenze: tutto spiegherebbe l'alterata funzione vescicale in senso eccitatorio o inibitorio. Le fibre C, esposte a ripetuti stimoli nocicettivi, resterebbero parzialmente depolarizzante, e ciò spiegherebbe il dolore. La funzione della NMS é quella di "neuromodulare" questi anomali ed involontari riflessi che coinvolgono il detrusore, la muscolatura del pavimento pelvico e gli sfinteri, intendendo con questo termine la capacità di migliorare la performance di un organo senza interferire con la sua normale funzione. Il meccanismo di azione della NMS non é stato ancora del tutto chiarito.
La valutazione della latenza di contrazione dello sfintere striato dell'ano in corso di NMS supporta l'ipotesi che essa agisca attraverso fibre nervose afferenti somatiche attraverso un riflesso polisinaptico 41.
Al contrario, la valutazione dei potenziali corticali corti e lunghi sembrerebbe indicare un coinvolgimento dei centri sovraspinali , probabilmente a livello dell'area corticale sensitiva 42.
Shaker, in un lavoro sperimentale sui ratti, ha ipotizzato che uno dei meccanismi di azione della NMS sia il blocco delle fibre C-afferenti 43. E tale inibizione causerebbe a sua volta una ridotta espressione del gene c-fos 44.
Inoltre la neurostimolazione a livello di S3 avrebbe un effetto farmacologico sulle pareti vescicali, aumentando la concentrazione urinaria di heparin-binding epidermal growth factor-like growth factor e riducendo la concentrazione di anti-proliferative factor, marker urinari correlati con i sintomi di CI 45.
A lungo termine, la NMS a bassa frequenza non produce danno neurologico, come dimostrato da studi condotti, con lunghi follow-up, su bambini sottoposti ad impianto 46 47.
La tecnica di NMS é stata messa a punto più di 25 anni fa da Tanagho e Schmidt ed é attualmente considerato un trattamento standard in caso di vescica iperattiva asciutta o bagnata resistente alle tradizionali terapie riabilitative e mediche 48. E' stato infatti dimostrata la capacità di questa terapia a modificare i parametri sensitivi nei pazienti con urge incontinence, incrementando il volume vescicale al quale si manifesta l'urgenza. Inoltre la NMS é in grado di ridurre l'ipertono del pavimento pelvico, spiegando il ruolo di questa terapia nel trattamento delle ritenzioni non ostruttive. Infine ci sono evidenze che essa é in grado di curare la vestibolite e la vestibolodinia e di normalizzare la funzione intestinale, tutte condizioni spesso associate alla CI.
Dopo un'accurata selezione delle pazienti si effettuta un test preliminare chiamato Peripheral Nerve Evaluation (PNE test).
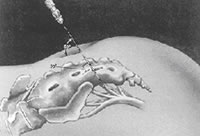
Con la paziente in posizione prona, si identifica il terzo formale sacrale, con l'aulisio di opportuni reperi oseei, ed in anestesia locale, si inserisce a questo livello un ago-elettrodo (Fig.1). Quest'ultimo é poi collegato con uno stimolatore esterno: per verificare il corretto posizionamento dell'elettrodo si valuteranno le risposte sensitive alla stimolazione (percezione della stimolazione a livello vaginale, delle grandi labbra, del perineo o dello scroto nei soggetti di sesso maschile) e/o motoria (contrazione "a soffietto" del perineo e flessione del dito alluce e occasionalmente delle altre dita del piede omolaterale. Viene quindi inserito un elettrodo temporaneo monopolare che viene lasciato "in situ" per un periodo di 7-14 giorni. Al termine di questo periodo la risposta clinica al trattamento é valutata in termini di frequenza, urgenza e dolore utilizzando un diario minzionale, una scala analogica visiva (VAS) e specifici questionari sulla qualità di vita.
La risposta al trattamento é considerata soddisfacente se c'é un miglioramento clinico di almeno il 50%. In questo caso si procede all'impianto definitivo che può avvenire in un unico tempo (posizionamento di elettrodo definitico quadripolare e del pace maker (IPG Interstim®) (Fig. 2) o in due tempi (posizionamento del solo elettrodo collegato con uno stimolatore esterno, valutazione della risposta clinica e quindi impianto del IPG).
Recentemente é stata messa a punto una tecnica percutanea che consente l'impianto dell'elettrodo definitivo in anestesia locale, con riduzione del tempo operatorio 49.
 |
 |
|---|---|
Fig.1 |
Fig.2 |
Maher et al hanno valutato un gruppo di 15 donne affette da CI mediante questionari specifici (SF-36 Health Survey, Short Urinary Di stress Inventory, diario minzionale ed analogo visivo per il dolore. Il PNE, durato 7-10 giorni, ha dimostrato una riduzione significativa del dolore pelvico, frequenza, nicturia ed urgenza, con un miglioramento significativo della Qualità di Vita. 11 dell 15 donne (73%) sono state candidate per l'impianto definitivo 50.
Withmore et al. hanno valutato 33 pazienti con diario minzionale ed un questionario specifico per la Qualità di Vita (O'Leary Sant Interstitial Cystitis Symptoms and Problem Indices - ICSI e ICPI). Dopo il PNE test, durato 7-10 giorni, é stato possibile mettere in evidenza un miglioramento statisticamente significativo della frequenza minzionale, del dolore, del volume urinato massimo e medio, e dei valori di ICSI e ICPI. Una valutazione urodinamica ha dimostrato assenza di effetti negativi sulla dinamica minzionale né danni neurologici secondari al trattamento. 17 pazienti (51.3%) sono state selezionate per l'impianto definitivo 51.
Complicanze della terapia sono: dolore nella sede di impianto del generatore o dell'elettrodo definitivo, e migrazione dell'elettrodo stesso.
Chai et al. hanno riportato i dati di uno studio eseguito su un gruppo di 6 pazienti affette da CI e sottoposte a PNE test della durata di 5 giorni. Essi hanno riportato una riduzione statisticamente significativa di frequenza, urgenza e dolore ed una normalizzazione di Heparin-Binding Epidermal Growth Factor e antiproliferative factor, che sono marker urinari di CI 45 .
Feloney e Culkin hanno studiato 8 pazienti sottoposti ad impianto definitivo di neuromodulatore sacrale con un follow-up di 18 mesi. Di questi 6 hanno riferito la persistenza della risposta clinica e in 5 (62.5%) non fu necessario associare altre terapie 52.
Questi dati sono stati confermato da un recente studio che dimostra come la terapia con IPG Interstim® riduca il dosaggio di oppioidi per il trattamento del dolore associato a CI 53.
Comiter ha studiato 16 donne e 1 uomo con CI sottoposti ad impianto definitivo con un follow-up di 16 mesi. Egli ha riferito una riduzione significativa del dolore pelvico, frequenza, nicturia e urgenza, con un miglioramento significativo della Qualità di Vita. 16 dei 17 pazienti (94%) hanno mostrato un miglioramento di "tutti" i parametri valutati 54.
Peters et al hanno valutato 26 pazienti (5 uomini 3 21 donne) con CI con un follow-up di 5-6 mesi dopo impianto definitivo. Essi hanno notato una riduzione di frequenza (72%), urgenza (68%), dolore pelvico (71%), QoL (76%) e dolore vaginale (69%). Il 96% dei pazienti dichiarava che si sarebbe sottoposto nuovamente ad impianto e che avrebbe raccomandato questa terapia ad un amico 55.
A tutt'oggi nonostante le numerose terapie proposte per il trattamento della CI, i risultati clinici sono ancora insoddisfacenti vista la genesi multifattoriale di questa patologia.
Il trattamento ideale dovrebbe poter trattare questa patologia mediante una terapia che abbia una adeguata risposta terapeutica ma con ridotti effetti collaterali vista la cronicità della malattia.
In quest'ottica, la NMS si configura come una valida alternativa terapeutica in caso di CI refrattaria alle tradizionali terapie, e prima di prendere in considerazione la chirurgia maggiore.
La possibilità di effettuare l'impianto definitivo in due tappe con la tecnica percutanea, che é procedura minimamente invasiva, consente una valutazione della risposta alla terapia migliore di quanto non consenta il PNE test, in quanto prevede l'utilizzo di un elettro quadripolare, in luogo del monopolare, una minore tendenza allo sposizionamneto dell'elettrodo ed un più lungo periodo di valutazione.
- Simon LJ, Landis R, Erickson DR: The Interstitial Cystitis Database study: concepts and preliminary baseline descriptive statitistics. Urology 1997; 49 (suppl 5A): 64-75.
- Baskin LS and Tanagho EA: Pain without pelvic organs. J Urol 1992; 147: 683-868.
- Bourque JP: Surgical management of the painfull bladder. J Urol 1951; 65: 25-35.
- Krean RM, Carr DD: Interstitial cystitis: a complex visceral pain sindrome. Pain Forum 1999; 8: 138-45.
- Oravisto KJ: Epidemiology of interstitial cystitis. Ann Chir Gynaecol 1975; 64: 75-77.
- Held PJ, Hanno PM, Wein AJ, etal: Epidemiology of interstitial cystitis: 2. In: Hanno PM, Staskin DR, Krane RJ, Wein AJ (eds) Interstitial cystitis. Springer, Heidelberg Berlin New York 1990: 29-48.
- Curhan GC, Speizer FE, Hunter DJ, et al: Epidemiology of interstitial cystitis: a population based study. J Urol 1999; 161: 549-52.
- Ratner V: Pain in interstitial cystitis; changing attitudes, changing treatment. Pain Forum 1999; 8: 154-57.
- Parsons CL, Lilly JD, Stein P: Epithelial dysfunction in nonbatterial cystitis (interstitial cystitis). J Urol1991; 145: 732-5.
- Hunt RE, Roy JB, Parson CL: The role of GAG in normal bladder fisiology and the phatophysiology of interstitial cystitis. Philaphia 1997: Chapter 11, pp.93-100.
- Niku SD: A new method for cytodestruction of bladder epithelium using protamine sulfate and urea. J Urol 1994; 152: 1025-1028.
- Ochcs RL: Autoantibodies in interstitial cystitis. J Urol 1994; 151: 587-592.
- Riedl CR: Electromotive drug administration and hydrodistension for the treatment of interstitial cystitis. J Endourol 1998; 12: 269-272.
- Pang X: Increased number of substance P positive nerve fibers in interstitial cystitis. Br J Urol 1995; 75: 744-750.
- Christmas TJ: Nerve fiber proliferation in interstitial cystitis. Virchows Arch 1990; 416: 447-451.
- Wesselmann U: Mechanism of referred visceral pain: uterine inflammation in the adult virgin rat results in neurogenic plasma extravasation in the skin. Pain 1997; 73: 309-317.
- McGillis JP: Immunomudulation by tachykinin neuropeptides. Ann N Y Acad Sci 1990; 594: 85-94.
- Rosamilia A: Activation of the kallikrein kinin system in interstitial cystitis. J Urol 1999; 162: 129-134.
- McMahon SB: NGF as a mediator of inflammatory pain. Philos Trans R Soc Lond B Biol Sci 1996; 351: 431-440.
- Anderstrom CRK: Scannin electron microscope findings in interstitial cystitis. Br J Urol 1989; 63: 270-275.
- Tait J: Urethral sindrome (a bacterial cystitis) search for a pathogen. Br J Urol 1994; 57: 552-556.
- O'Leary MP, Sanr GR, Fowler FJ, et al: The interstitial cystitis symptom index and problem index. Urology 1997; 49 (Suppl 5°): 58-63.
- Parsons CL, Dell J, Stanford EJ: The prevalence od interstitial cystitis in gynecologic patients with pelvic pain as detected by intravesicular potassium sensitivity. Am J Obstet Gynecol 2002; 187: 1395-400.
- Parsons CL: Potassium sensitivity test. Tech Urol 1996; 2: 171-3.
- Daha LK, Riedl CR, Hohlbrugger G, et al: Comparative assessment of maximal bladder capacity, 0,9 NaCl versus 0,2 KCl, for the diagnosis of interstitial cystitis. A prospective controlled study. J Urol 2003; 170: 807-9.
- Brookoff D and Bennet DS: Neuromodulation in intractable interstitial cystitis and related pelvic pain syndromes. Pain Medicine 2006; 5, 51: 166-84.
- Hanno PM: Forging an international consensus. Progress in painful bladder sindrome and interstitial cystitis. Int Urogynecol J 2005; 16: S2: 34.
- Klinger HC, Pycha A, Schmidbauer J, et al: Use of peripheral neuromodulation of the S3 region for the treatment of detrusor overactivity: A urodynamic-based study. Urology 2000; 56: 766-71.
- Messing EM: Interstitial cystitis and related syndromes. In: Walsh PC, Retik AB, Stamey TA, Darracott-Vaughan E Jr, eds. Campbell's Urology. 3rd editino. Philadelphia, PA: W.B. Saunders; 1992: 982-1005.
- Koziol JA, Adams HP, Frutos A: Discrimination between the ulcerous and the non-ulcerous forms of interstitial cystitis by non-invasive findings. J Urol 1995; 155: 87-90.
- Waxman JA, Sulak PJ, Kuehl TJ: Cystoscopic findings consistent with interstitial cystitis in normal women undergoing tubal ligation. J Urol 1998; 160: 1663-7.
- Messing EM: Interstitial cystitis and related syndromes in Walsh PC, Gittes R, Perlunettar A. Campbell's Urology; Sounders Wb 1986: 982-1005.
- Webster GD, Galloway N: Surgical treatment of interstitial cystitis. Indications, techniques and results. Urology 1987; 29: 34-39.
- Hohenfellner M, Linn J, Hampel C, et al: Surgical treatment of interstitial cystitis, In: sant GR, ed. Interstitial cystitis. Philadelphia. Lippincot-Raven 1997: 223-233.
- Baskin LS, Tanagho EA: Pelvic pain without pelvic organs. J Urol 1992; 147: 683-686.
- Geirsson G, Wang YH, Lindstrom S, Fall M: Tradidional acupunture and electrical stimulation of the posterior tibial nerve. Scand J Urol Nephrol 1993; 27: 67-70
- Fall M, Carlsson CA, Erlandson BE: Electrical stimulation in interstitial cystitis. J Urol 1980; 123: 192-195.
- Geirsson G, Wang YH, Lindstrom S, Fall M: Traditional acupuncture and electrical stimulation of the posterior tibial nerve. Scand J Urol Nephrol 1993; 27: 67-70.
- Fall M: Transcutaneous electrical nerve stimulation in interstitial cystitis. Urology 1987; 29 (Suppl): 40-42.
- Fall M: Conservative management of chronic interstitial cystitis: transcutaneous electrical nerve stimulation and transurethral resection. J Urol 1985; 133: 774.
- Fowler CJ, Swinn MJ, Goodwin RJ, et al: Studies of the latency of pelvic floor contraction during peripheral nerve evaluation show that the muscle response is reflexy mediated. J Urol 2000; 163 (3): 881-883.
- Braun PM, Baezner H, Seif, et al: Alterations of cortical electrical activity in patients with sacral neuromodulator. Eur Urol 2002; 41 (5): 562-566.
- Shaker H, Wang Y, Loung D et al: Role of C-afferent fibres in the mechanism of action of sacral nerve root neuromodulation in chronic spinal cord injury. BJU Int 2000; 85 (7): 905-910.
- Wang Y and Hassouna MM: Neuromodulation reduces c-fos gene expression in spinalized rats: a double-blind randomized study. J Urol 2000; 163 (6): 1966-1970
- Chai TC, Zhang C, Warren JW, et al: Percutaneous sacral third nerve root neurostimulation improves symptoms and normalizes urinary HB-EGF levels and antiproliferative factor in patients with interstitial cystitis. Urology 2000; 55: 643-6.
- Elabbady HA, Hassouna MM, Ethilal MM: Neuromodulation for chronic voiding dysfunction. J Urol 1994; 152: 287-91.
- Tanagho EA, Schmidt RA: Elettrical stimulation in the management of the neurogenic bladder. J Urol 1998; 140: 1331-5.
- Abrams P, Blaivas JG, Fowler CJ, et al: The role of neuromodulation in the management of urinary urge incontinence.
- Spinelli M, Giardiello G, Gerber M et al: New sacral neuromodulation lead for percutaneous implantation using local anesthesia: description and first experience. J Urol 2003; 170 (5): 1905-1907
- Maher CF, Carey MP, Dwyer PL, Schulter PL: Percutaneous sacral nerve root neuromodulation for intractable interstitial cystitis. J Urol 2001; 165: 885-886
- Whitmore KE, Payne CP, Diokno AC, Lukban JC: Sacral neuromudulation in patients with interstitial cystitis: a multicenter clinical trial. Int Urogynecol J 2003; 14: 305-309.
- Feloney MP and Culkin DJ: Neuromodulation for the treatment of refractory severe interstitial cystitis. J Urol 2001; 165 (Suppl): 66.
- Peters KM, Konstadt D: Sacral neuromodulation decreases narcotic requirements in refractory interstitial cystitis. BJU Int 2004; 93: 777-9.
- Comiter CV: Sacral neuromodulation for the symptomatic treatment of refractory intestitial cystitis: a prospective study. J Urol 2003, 169: 1369-1373.
- Peters KM, Carey JM, Konstandt DB: Sacral neuromodulation for the treatment of refractory interstitial cystitis: outcomes based on technique. J Urol 2003; 169: 1369-1373.
Unità Operativa Complessa di Urologia Ginecologica (Primario Prof. Mauro Cervigni)
Ospedale S. Carlo - IDI Sanità , Roma